Причины развития
В процессе эмбрионального развития кишечник в 3 этапа совершает поворот, переходя от первичного состояния кишечной трубки в окончательное. Начинается процесс вращения кишечника на 5-й неделе внутриутробной жизни.
Первый этап вращения тянется до 10-й недели. В это время кишечник увеличивается в размерах, и не помещающиеся в брюшной полости из-за больших размеров печени удлинившиеся петли кишечника выталкиваются через пупочное кольцо. Расположенные в пуповинных оболочках петли кишечника образуют физиологическую кишечную грыжу.
При этом часть кишечной трубки совершает поворот на 90° и 180° против часовой стрелки вокруг верхней брыжеечной артерии.
Приблизительно к 10-й неделе брюшная полость относительно увеличивается в объеме, поэтому петли кишечника постепенно возвращаются в абдоминальную полость и физиологическая пупочная грыжа вправляется.
Таким образом, выпячивание петель кишечника в пупочный канатик является нормой на сроке беременности между 6-й и 10-й неделями.
При нарушении процесса вращения кишечника, недоразвитии брюшной полости или нарушении замыкания брюшной стенки в пуповинных оболочках остается часть органов, поэтому в дальнейшем у ребенка выявляется омфалоцеле.
К факторам риска образования грыжи пупочного канатика относятся:
- Употребление матерью некоторых лекарственных препаратов.
- Курение.
- Возраст матери, превышающий 35 лет. В этот период повышается риск развития хромосомных аномалий – у пациенток до 35 лет сочетанную грыжу пупочного канатика у плода выявляют в 28 % случаев, а у пациенток старше 35 лет – в 54,5% случаев. Среди сопровождающих пуповинную грыжу хромосомных аномалий наиболее часто встречается сопровождающаяся комплексом множественных пороков развития трисомия 18 (Синдром Эдвардса) и трисомия 13 (Синдром Патау).
- Наличие сопутствующих пороков развития.
Данный дефект также может являться компонентом:
- Синдрома Беквита – Видемана. Для этого генетически-обусловленного заболевания характерно сочетание быстрого, гипертрофичного роста (макросомии), пуповинной грыжи, макроглоссии (большого, не помещающегося во рту языка), неонатальной гипогликемии и предрасположенности к эмбриональным опухолевым образованиям.
- Пентады Кантрелла. Для данного редкого синдрома характерно сочетание врожденных дефектов брюшной стенки, сердца, перикарда, грудины и диафрагмы.
- Синдрома амниотических тяжей, который проявляется в пороках развития, вызванных сдавливанием плода амниотическими тяжами.
- Аномалии развития стебля тела, для которого характерно наличие эвентрации (выхода внутренностей за пределы брюшной полости), эктопии (ненормального положения) сердца, выраженной деформации позвоночника и конечностей.
- Комплекса конечность – стенка туловища.
- OEIS комплекса, который включает экстрофию клоаки, атрезию (отсутствие, заращение) ануса и дефекты позвоночника.
Хромосомные аномалии выявляются только при сочетанных пуповинных грыжах (46,4 % от всех случаев выявления данной формы).
Как развиваются грыжи
Как правило, пациенты, у которых развиваются грыжи, имеют определенные особенности телосложения и строения соединительной ткани и без того теряющей свою упругость с возрастом. Общее название этих изменений – «синдром слабости соединительной ткани». Современные исследования подтвердили у таких больных нарушения метаболизма коллагена – основного каркасного белка соединительной ткани.
Факторами, способствующими клиническому проявлению грыжи, являются уменьшение (гипотрофия) мышц передней брюшной стенки, повышение внутрибрюшного давления при асците, ожирении, беременности, дискинезии кишечника. Возникновению пупочной грыжи у женщин способствуют многократные беременности и тяжелые роды. Отверстия и щели между мышцами брюшной стенки могут увеличиваться при резком похудании.
Послеоперационные грыжи возникают на месте дефекта ткани, истончения послеоперационного рубца чаще после различных осложнений в области послеоперационного шва (нагноение, инфильтрация и т.п.). У пациентов с онкологическими заболеваниями послеоперационные грыжи могут развиваться на поздних стадиях по факту резкого снижения массы тела, в том числе при развитии раковой кахексии.
Как предупредить патологию?
К мерам профилактики гастрошизиса относится четкое выполнение советов акушера-гинеколога, начиная с планирования беременности:
- полноценное питание будущей матери;
- отказ от вредных привычек задолго до зачатия;
- своевременное посещение врача и проверка анализов;
- проведение УЗИ для наблюдения за плодом.
При имеющихся сведениях о наследственной предрасположенности лучше пройти генетическую консультацию обоим родителям до зачатия. По желанию матери и медицинским показаниям возможно прерывание беременности в срок до 22 недель. Педиатры наблюдают ребенка до взросления. Помогают расти и становиться здоровым. Родители должны следовать советам. В большинстве случаев возможно излечение.
Причины образования гастрошизиса
Точная этиология гастрошизиса неизвестна. Генные или хромосомные изменения плода могут быть причиной возникновения такого расстройства.
Есть теория о том, что аномалия возникает из-за нарушения кровоснабжения плода в течение первых восьми недель беременности, вследствие чего брюшная стенка не может правильно развиваться. Это приводит к образованию небольшого отверстия рядом с пуповиной, а кишечник и другие органы брюшной полости выталкиваются наружу.
Ещё одна теория подразумевает недостаточность мезодермы (слоя клеток) в формировании стенок тела. Однако эта гипотеза не объясняет возникновения дефекта мезодермы в этом конкретном месте.
Также специалисты полагают, что причиной гастрошизиса может послужить разрыв амниона (зародышевой оболочки) вокруг пупочного кольца, но тогда остаётся не ясным тот факт, что гастрошизис встречается гораздо реже по сравнению с пупочной грыжей.
Из чего состоит грыжа?
Все грыжи, независимо от локализации и размеров, имеют общее строение и состоят из следующих компонентов:
- Грыжевые ворота – это дефект передней брюшной стенки, преимущественно, в апоневрозе. Через них внутренние органы выходят из живота и оказываются под кожей. Если грыжевые ворота широкие, то через них содержимое может свободно возвращаться в брюшную полость.
- Грыжевой мешок – листок растянутой брюшины, покрывающий органы, вышедшие за пределы брюшной полости через грыжевые ворота. Грыжевой мешок покрыт несколькими оболочками, к ним относятся также подкожная клетчатка и кожа.
- Содержимого грыжевого мешка – это внутренние органы или отдельные их части, выходящие за пределы брюшной полости, через грыжевые ворота.
Омфалоцеле у плода на 12 неделе
Омфалоцеле считается серьезным пороком развития ребенка. Начинается этот процесс после 10 недель беременности. При отсутствии раздражителей и негативных факторов, кишечник, со всем его содержимым, должен возвратиться в брюшную полость до конца 11 недели.
На скрининге, под конец первого триместра беременности (11 — 13 недель), часто можно наблюдать выхождение кишечника эмбриона за пределы брюшной полости. Это нормальное физиологическое явление.
 Для нормального развития плода, характерно увеличение пуповины до 7 мм, в связи с выпячиванием петель кишечника. Происходит это на 12-ой неделе беременности, поэтому мамам не стоит паниковать преждевременно. Когда содержимое кишечника начинает формировать отдельную субстанцию, не покрытую оболочкой за своими пределами, можно говорить о наличии сопутствующих пороков развития передней стенки.
Для нормального развития плода, характерно увеличение пуповины до 7 мм, в связи с выпячиванием петель кишечника. Происходит это на 12-ой неделе беременности, поэтому мамам не стоит паниковать преждевременно. Когда содержимое кишечника начинает формировать отдельную субстанцию, не покрытую оболочкой за своими пределами, можно говорить о наличии сопутствующих пороков развития передней стенки.
Особенности диагностики
В первую очередь, следует подчеркнуть, что патологию достаточно просто выявить еще во время беременности. На сроке 11 недель каждая женщина проходит скрининг. В норме на данном этапе развития допускается наличие физиологической грыжи. Но в этом случае диаметр пуповины не должен превышать 7 мм. Если же на этом сроке имеются отклонения, рекомендуется провести повторный скрининг через 5-6 недель, когда формирование и ротация органов завершатся. Кроме того, нужно помнить, что врач может ошибаться и сразу впадать в панику нельзя.
Особенно внимательно следует подойти к планированию беременности женщинам с отягощенным анамнезом. При наличии выкидышей в прошлом, врожденных аномалий рекомендуется выполнять скрининг чаще.
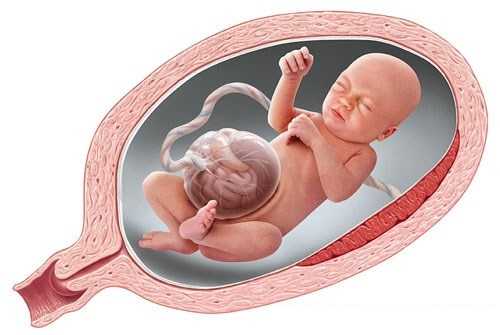
Выявить заболевание у ребенка можно во время скрининга при беременности
Отдельно следует рассмотреть теорию, касающуюся аминокислоты гомоцистеин. В норме ее количество постепенно повышается, но с наступлением беременности уровень содержания вещества снижается и сохраняется в этом положении до конца беременности. Возвращается к норме гомоцистеин через 6-7 дней после родов.
Причинами повышения уровня аминокислоты может быть недостаток витамина В. Также на нем сказывается курение, употребление алкоголя и даже недостаток движения
Но, что особенно важно, существует мнение, что гомоцистеин повышен у женщин с риском рождения детей с врожденной аномалией и он имеет прямое отношение к развитию омфалоцеле. Поэтому если имеются риски рождения малыша с патологией, рекомендуется сдавать анализ крови на гомоцистеин на тех же сроках, на которых выполняется скрининг
Список литературы
- Пороки развития диафрагмы. В кн.: Исаков Ю.Ф., Володин Н.Н., Гераськин А.В., ред. Неонатальная хирургия. М.: Династия; 2011: 332–58.
- Юдина Е.В. Легкие. В кн.: Медведев М.В., ред. Пренатальная эхография. М.: Реальное Время; 2005: 341–71.
- Некрасова Е.С. Пренатальная ультразвуковая диагностика и тактика ведения беременности при диафрагмальной грыже плода. Ультразвуковая и функциональная диагностика. 2011; 2: 47–56.
- Garne E., Haeusler M., Barisic I., Gjergja R., Stoll C., Clementi M.; Euroscan Study Group. Congenital diaphragmatic hernia: evaluation of prenatal diagnosis in 20 European regions. Ultrasound Obstet. Gynecol. 2002; 19(4): 329–33.
- Гусева О.И. Перинатальные исходы и прогноз при диафрагмальной грыже. Ультразвуковая и функциональная диагностика. 2005; 6: 19–27.
- Пуйда С.А. Ультразвуковая пренатальная диагностика врожденных аномалий органов дыхания: Автореф. дис. … канд. мед. наук. СПб.; 2007. 16 с.
- Gucciardo L., Deprest J., Done’ E., Van Mieghem T., Van de Velde M., Gratacos E. et al. Prediction of outcome in isolated congenital diaphragmatic hernia and its consequences for fetal therapy. Best Pract. Res. Clin. Obstet. Gynaecol. 2008; 22(1): 123–38.
- Eroglu D., Yanik F., Sakallioglu A.E., Arikan U., Varan B., Kuscu E. Prenatal diagnosis of bilateral diaphragmatic hernia by fetal sonography. J. Obstet. Gynaecol. Res. 2006; 32(1): 90–3.
- Song M.S., Yoo S.J., Smallhorn J.F., Mullen J.B., Ryan G., Hornberger L.K. Bilateral congenital diaphragmatic hernia: diagnostic clues at fetal sonography. Ultrasound Obstet. Gynecol. 2001; 17(3): 255–8.
- Rais-Bahrami K., Hsiao D., Short B.L., Baumgart S. Bilateral congenital diaphragmatic agenesis. J. Neonatal Perinatal Med. 2008; 1(1): 59–62.
- Bedoyan J.K., Blackwell S.C., Treadwell M.C., Johnson A., Klein M.D. Congenital diaphragmatic hernia: associated anomalies and antenatal diagnosis. Outcome-related variables at two Detroit hospitals. Pediatr. Surg. Int. 2004; 20(3): 170–6.
- Jani J., Keller R.L., Benachi A., Nicolaides K.H., Favre R., Gratacos E.; Antenatal-CDH-Registry Group. Prenatal prediction of survival in isolated left-sided diaphragmatic hernia. Ultrasound Obstet. Gynecol. 2006; 27(1): 18–22.
- Heling K.S., Wauer R.R., Hammer H., Bollmann R., Chaoui R. Reliability of the lung-to-head ratio in predicting outcome and neonatal ventilation parameters in fetuses with congenital diaphragmatic hernia. Ultrasound Obstet. Gynecol. 2005; 26(2): 112–8.
- Sharland G.K., Lockhart S.M., Heward A.J., Allan L.D. Prognosis in fetal diaphragmatic hernia. Am. J. Obstet. Gynecol. 1992; 166(1, Pt1): 9–13.
- Metkus A.P., Filly R.A., Stringer M.D., Harrison M.R., Adzick N.S. Sonographic predictor of survival in fetal diaphragmatic hernia. J. Pediatr. Surg. 1996; 31(1): 148–51.
- Jani J., Nicolaides K.H., Keller R.L., Benachi A., Peralta C.F., Favre R. et al.; Antenatal-CDH-Registry Group. Observed to expected lung area to head circumference ratio in the prediction of survival in fetuses with isolated diaphragmatic hernia. Ultrasound Obstet. Gynecol. 2007; 30(1): 67–71.
- Deprest J.A., Flemmer A.W., Gratacos E., Nicolaides K. Antenatal prediction of lung volume and in-utero treatment by fetal endoscopic tracheal occlusion in severe isolated congenital diaphragmatic hernia. Semin. Fetal Neonatal Med. 2009; 14(1): 8–13.
- Harrison M.R., Keller R.L., Hawgood S.B., Kitterman J.A., Sandberg P.L., Farmer D.L. et al. A randomized trial of fetal endoscopic tracheal occlusion for severe fetal congenital diaphragmatic hernia. N. Engl. J. Med. 2003; 349(20): 1916–24.
- Щитинин В.Е., Арапова А.В., Мельникова Н.И., Е.В. Карцева Е.В., Кузнецова Е.В. Врожденная диафрагмальная грыжа у новорожденных группы высокого риска. Российские медицинские вести. 2004; 3: 57–9.
- Патент – 2476156 РФ, МПК А61 В 8/06. Способ пренатального прогнозирования состояния новорожденного с врожденной диафрагмальной грыжей. В.Н. Демидов, Н.В. Машинец, Ю.И. Кучеров, Ю.В. Жиркова, А.А. Буров; ФГБУ НЦАГиП им. В.И.Кулакова Министерства здравоохранения и социального развития РФ. N 2011139531/14; Заявлено 29.09.2011; Опубл. 27.02.2013, Бюл. N 6.
Опасно ли проводить операцию при Омфалоцеле
Сейчас нет никаких сложностей для проведения операции по устранению Омфалоцеле. Опасность заключается лишь в несвоевременном удалении патологии, так как на ее фоне у ребеночка начинают формироваться другие отклонения в развитии.
Отсутствие рационального лечения побуждает следующие осложнения:
- разрыв пуповины и выпадение внутренних органов;
- сепсис;
- возникает некроз тканей;
- при инфицировании может развиваться гангрена;
- кишечная непроходимость;
- внутренние кровоизлияния.
Внимание! Отсутствие оперативного лечения при сочетанном Омфалоцеле, может приводить к летальному исходу.
Симптоматика
Основу клинической картины у новорожденных составляет присутствие ярко выраженного грыжевого дефекта на передней стенке брюшной полости. При изолированном протекании иных признаков патологии не отмечается.
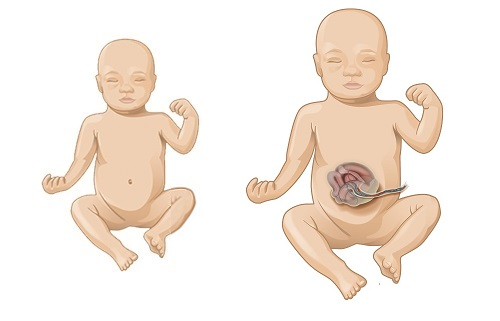 Омфалоцеле у ребенка
Омфалоцеле у ребенка
Если омфалоцеле плода сочетается с иными пороками развития, клиника может включать в себя:
- внутриутробную задержку роста плода;
- гипоплазию легких;
- эктопию сердца;
- макросомию;
- макроглоссию;
- затрудненное дыхание;
- гигантизм;
- гипогликемию;
- гиперинсулинизм;
- наличие большого языка;
- незаращение желчного протока.
Из этого следует, что симптоматическая картина носит индивидуальный характер и зависит от этиологического фактора.
Омфалоцеле плода — что это такое?
Омфалоцеле встречается у 2-3 детей на 10 000 случаев живорождения. Диагностирование данного порока, на этапе современных возможностей пренатальной диагностики, не составляет труда. Но встречаются ложноположительные результаты, часто связанные с тем, что за омфалоцеле принимается физиологическое «грыжевое» выпячивание кишечных петель у плода. Происходит оно на этапе ротации (поворота) органов, что является нормальным процессом развития органов пищеварительного тракта. При этом брюшная полость мала и брюшина не до конца сформирована, поэтому для нормального развития кишечника и его ротации часть петель выходит через «слабое» место, а после завершения всех процессов возвращается на место и прикрывается сформировавшейся брюшиной. Происходит этот этап развития в сроки с 9 по 14 неделю гестации. Именно в этот период и возникают огрехи диагностики омфалоцеле и гастрошизиса (выход кишечника и желудка через дефектное отверстие в передней стенке живота). Поэтому диагноз омфалоцеле более достоверен при обследовании, начиная с 15 недели беременности.
Ультразвуковая картина омфалоцеле отображает собой визуализацию кишечника в области пуповинного кольца, выходящего за пределы полости живота. При подозрении на наличие омфалоцеле при обследовании в женском центре, специалист, проводивший УЗИ, совместно с врачом, ведущим беременную, решают вопрос о перенаправлении женщины на пренатальную комиссию. В состав перинатального консилиума входят: акушер-гинеколог, генетик и неонатолог, кардиолог, детский хирург и реаниматолог. Учитывая высокую вероятность сочетанных пороков жизненно важных систем, рассматриваются возможность их курабельности, жизнеспособности новорожденного, варианты хирургической и объем реанимационной помощи, подбирается тактика ведения текущей беременности, характер способа ведения родов, определяется прогноз инвалидности, адекватность развития ребенка в будущем.
Омфалоцеле новорожденного и плода редко встречается в изолированной форме. Очень часто эта аномалия является составляющей набора симптомов, характерных для определенного хромосомного заболевания. В научной литературе описано более 20 синдромов, где обязательным является наличие омфалоцеле. Наиболее распространенные из них: трисомия по 18 паре (Эдвардса синдром) и трисомия по 13 паре (Патау синдром), синдром Беквита-Видемана и трисомия по 21 паре (Дауна синдром). Врожденные аномалии, с высокой частотой встречаемости, которые сочетаются с омфалоцеле это:
— Клоакальная экстрофия (порок брюшной стенки, с выходом мочевого пузыря, разделенного надвое толстым кишечником, наружу);
— Пентада Кантрелла (дефект грудной стенки, дефект перикарда (серозной оболочки сердца), порок сердца с его выходом в дефект грудной стенки, диафрагмальная грыжа, омфалоцеле);
— Синдром амниотических тяжей (нити, образующиеся из стенок плодного пузыря, которые опутывают части тела и вызывают различные пороки);
— Аномалии развития стебля тела (порок развития стенки тела со стороны живота, сопровождающийся выходом органов брюшной полости наружу, аномалией положения сердца, пороками позвоночника и конечностей).
В плане ведения беременности, отягощенной наличием омфалоцеле плода, обязательным пунктом является консультация генетика, с проведением кариотипирования (определения количественного и качественного хромосомного набора). Могут быть проведены такие инвазивные (проникающие внутрь организма) исследования как:
— Амниоцентез (прокол стенки плодного пузыря для забора пробы амниотических (околоплодных) вод);
— Хорионбиопсия (взятие для анализа тканей хориона (внешняя оболочка плода) через цервикальный канал);
— Кордоцентез (через прокол стенки плодного пузыря производится забор пуповинной крови плода).
На основании полученных данных и решения консилиума, специалистами решается вопрос о целесообразности и возможности сохранения беременности. Если же по заключению пренатальной комиссии беременность продолжается, то способ родоразрешения выбирается индивидуально в каждом случаем, если размеры омфалоцеле небольшие, то разрешены естественные роды. Но, в большинстве случаев, проводится извлечение плода посредством кесарева сечения.
Омфалоцеле: причины
Точной причины, как и фактора, вызывающего омфалоцеле новорожденного и плода, на данный момент не найдено. Наиболее вероятно возникновение порока в момент совершения вращения при повороте кишечника – обязательного и физиологического этапа в развитии пищеварительного тракта. При нарушении момента вращения, сохраняется «физиологическая» пупочная грыжа, которая сочетаясь с дефектом развития брюшины, образует омфалоцеле. Существует теория, что данная патология может возникать еще на этапе закладки и формирования зародышевых тканей, из которых в перспективе будут образовываться органы и составляющие брюшной стенки.
Омфалоцеле относится к эмбриофетопатиям, то есть развивается в эмбриональный период (три первых месяца беременности). Поэтому наиболее важным и ответственным отрезком времени в развитии плода является первый триместр, так называемый, «критический» период.
Факторы, провоцирующие развитие различных аномалий, уродств и пороков развития плода:
— экстрагенитальная (несвязанная с заболеваниями органов половой сферы) патология беременной: заболевания дыхательной, сердечно-сосудистой систем, эндокринопатии, генетические и хромосомные аномалии, заболевания крови, онкопатология, рост меньше 150 см;
— наркомания, пристрастие к алкоголю, табакокурение как будущей матери, так и отца;
— отягощенный акушерский анамнез: молодой возраст (до 18 лет), возрастная первобеременная (от 35 лет), привычное невынашивание и рождение маленьких к гестационному сроку детей, бесплодие любой этиологии, смерть детей во внутриутробном, родовом и раннем неонатальном (первые 7 суток) периоде, случаи рождения детей с пороками развития;
— прием тератогенных (вызывающих уродства плода) препаратов: соли лития, Варфарин, Колхицин, Аминоптерин, Хинин, Талидомид и др.;
— акушерские осложнения текущей беременности (ранний тяжелый токсикоз и угроза прерывания, внутриутробное инфицирование, индуцированная беременность и иммунологический конфликт и др.;
— воздействие на беременную вредных внешнесредовых факторов (бытовые, производственные химические токсины, радиация, воздействие патологических температур, шума и вибрации).
Диагностика
Диагноз ставится на основании:
- Серийных ультразвуковых исследований.
- Результатов УЗИ и данных биохимического анализа крови, полученных в один день (скрининговое исследование, которое проводится в 11-13 недель). Позволяет рассчитать риск наличия хромосомных аномалий у плода. При низком индивидуальном риске хромосомных аномалий УЗИ повторяется через 2-3 недели, поскольку к этому времени физиологическая грыжа обычно вправляется.
- Амниоцентеза (пункции амниотической оболочки), который позволяет получить околоплодные воды для проведения пренатального кариотипирования и исключения сочетанных аномалий.
Проводится также пренатальное медико-генетическое консультирование.
Повторное УЗИ для тщательной оценки анатомии плода, позволяющее исключить сочетанные пороки развития, проводится в 18-20 недель.
Омфалоцеле необходимо дифференцировать с гастрошизисом, признаком которого являются визуализирующиеся отдельно от области вхождения в брюшную полость пуповины части органов брюшины, не покрытые оболочкой.
При случающемся в 10 – 18% случаев разрыве оболочек грыжевого мешка отграничить эмбриональную грыжу от гастрошизиса затруднительно.
Иллюстрации
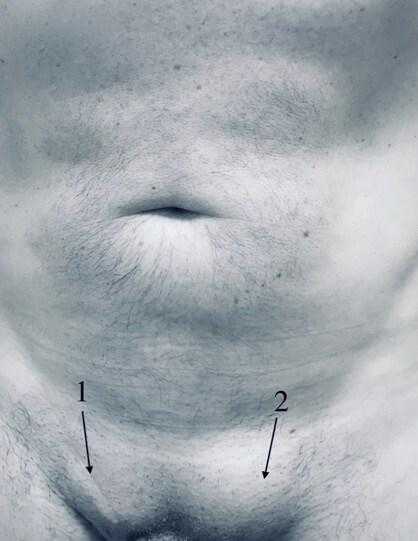
Вид передней брюшной стенки мужчины с паховой грыжей:
- Послеоперационный рубец после устранения правосторонней паховой грыжи 6 лет назад. Пластика по Лихтенштейну.
- Левосторонняя паховая грыжа.
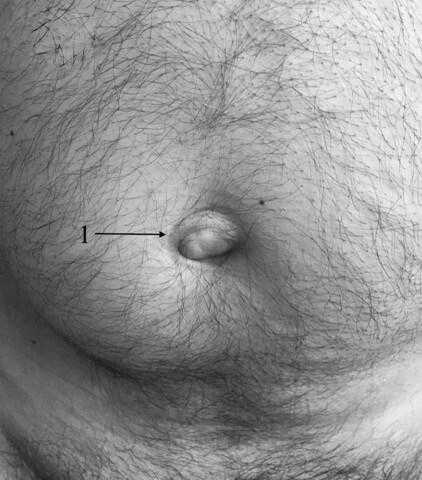
Вид передней брюшной стенки мужчины с пупочной грыжей
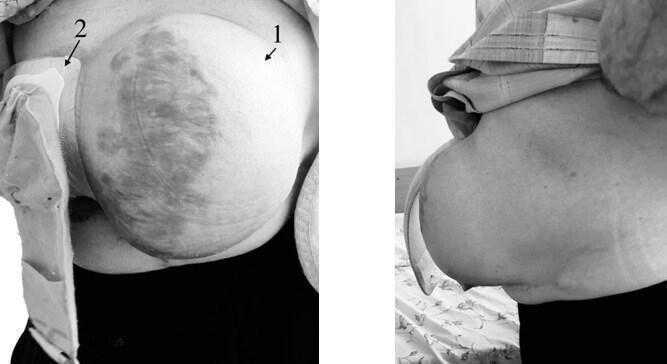
Пациент И. 75 лет. Передняя брюшная стенка мужчины с гигантской послеоперационной грыжей. За 8 лет грыжевой дефект распространился на четыре анатомические области.
- Гигантская послеоперационная грыжа передней брюшной стенки.
- Колостома.

Пациент И. 75 лет. 1 месяц после выполнения симультанной операции: устранения гигантской послеоперационной грыжи с пластикой сетчатым протезом и восстановления непрерывности кишечника.
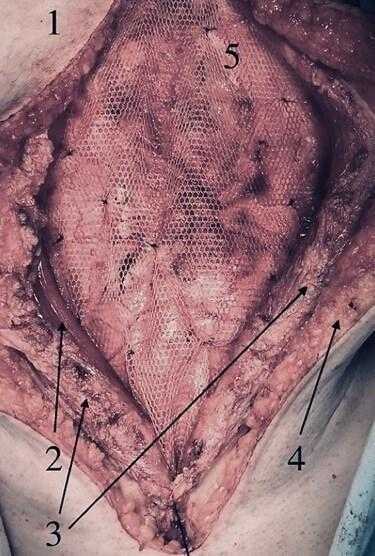
Один из этапов хирургического лечения гигантской грыжи передней брюшной стенки. Фиксация сетчатого трансплантата на место грыжевого дефекта. Цифрами указаны слои передней брюшной стенки и сетчатый протез.
Обследования для подтверждения диагноза
В неосложнённых случаях грыжи обычно достаточно стандартного предоперационного обследования. Диагноз ставится при обычном клиническом осмотре врачом-хирургом. В сомнительных случаях хирург пробует ввести палец в предполагаемый грыжевой канал и просит пациента натужиться или покашлять. При этом ощущается толчок, свидетельствующий о наличии грыжи. Проведение ультразвукового исследования у пациента в вертикальном положении позволяет обнаружить истончение тканей передней брюшной стенки в области грыжевых ворот.
В осложненных случаях в грыжевом мешке при проведении УЗИ можно обнаружить соответствующие органы – кишечник, мочевой пузырь и прочие.
При наличии тошноты, рвоты, болей и отсутствия ущемления органов в грыжевых воротах приходится исключать другие заболевания с подобной симптоматикой. Бывает, что грыжи белой линии живота сопутствуют язвенной болезни, раку желудка, холециститу и др.
Лечение при ретрохориальной гематоме
Лечить ретрохориальную гематому рекомендуется, в основном, потому что только там можно обеспечить реально полный физический покой и отсутствие всяческой нагрузки. Никакие обещания «все время лежать» дома реализовать невозможно — всегда найдется куча неотложных домашних дел, которые захочется сделать — от уборки до стирки. Кроме того, в стационаре в любой момент могут оказать экстренную помощь — внутривенное введение гемостатиков, например. Если возможности лечь в стационар нет, то стоит рассмотреть вариант дневного посещения клиники или же остаться на пару-тройку дней у нас.
В нашем стационаре оборудованы палаты класса люкс, предлагается вкусное и сбалансированное питание, проводятся все медицинские процедуры по назначению врача.
Каждая беременная женщина окружена заботой и вниманием. Здесь вы сможете в комфортной обстановке пройти лечение, сохранить беременность и дождаться момента, когда жизни и здоровью ребенка ничего не будет угрожать.
Условия зависят от вашей конкретной ситуации, обсуждаются на приеме у гинеколога
Рекомендован постельный режим, при этом с целью восстановления оттока крови советуют лежать, подложив под область таза валик, например из свернутого одеяла. Для профилактики застойных явлений в кишечнике рекомендуется соблюдать диету: исключить бобовые, острые блюда; продукты закрепляющие стул или усиливающие перистальтику кишечника (шоколад, грубая клетчатка). Переполненный газами кишечник давит на беременную матку и повышает тонус матки, чем способствует усилению угрозы прерывания беременности и увеличению размеров гематомы. Также для снижения рисков повышения тонуса матки нужно ограничить употребление крепкого чая и кофе.
Медикаментозная терапия состоит в применении препаратов, улучшающих свертываемость крови, за счет которых останавливается кровотечение, и гематома перестает расти (транексам, дицинон, викасол). Для снятия гипертонуса матки, из-за которого гематома может нарастать, применяются спазмолитики (но-шпа, метацин, свечи с папаверином). С целью нормализации гормональной регуляции в организме применяется метаболическая витаминотерапия. Используются препараты прогестерона. При этом схема и путь введения подбирается врачом индивидуально, это могут быть как препараты для внутримышечного введения (масляный раствор прогестерона), так и свечи (утрожестан, ипрожин), таблетки (дюфастон) или гель (крайнон). Надо заметить, что при появлении кровянистых выделений из половых путей утрожестан продолжают вводить интравагинально. Эффективность его при этом не снижается!
Лечение как правило продолжается от 2 до 4 недель, по показаниям проводится повторно в критические сроки (12–14, 20–24, 28–32, 36–38 недель). Рассасывание гематомы обычно происходит от 2-х до 4-5-ти недель.
Лечение
При обнаружении у ребенка эмбриональной грыжи родоразрешение проводится в перинатальном центре (роды могут быть вагинальными или путем кесарева сечения), после чего новорожденный переводится в специализированное хирургическое отделение.
Лечение омфалоцеле может быть:
- Оперативным. В зависимости от размеров грыжевого выпячивания вправление эвисцерированных органов может проводится в один этап или в два этапа (к краям дефекта подшивается воронкообразный мешок из синтетического материала или консервированной брюшины, позволяющий вправить выпячивание при помощи постепенного уменьшения объема этого мешка). Заключительным этапом является проводимая с косметической целью операция по образованию пупка.
- Консервативным. Заключается в обработке грыжевого мешка нитратом серебра или другими эпителизирующими средствами. Применяется при наличии тяжелых сочетанных пороков, исключающих проведение радикальной операции. При данном методе лечения из-за риска инфицирования и разрыва грыжевой оболочки требуется более длительная госпитализация. Со временем образовавшуюся вентральную грыжу оперируют.
Оперативное лечение в большинстве случаев проводят в первые 24 – 48 часов жизни.
Омфалоцеле с узкими грыжевыми воротами, которое содержит кишечник, требует экстренного вмешательства на протяжении 12 часов, так как возникает риск ущемления кишечных петель и развития кишечной непроходимости.
Предоперационная подготовка включает:
- накладывание пластиковой термоизолирующей повязки;
- декомпрессию желудка при помощи назогастрального зонда;
- помещение в кювез для поддержания теплового режима и уменьшения потери жидкости;
- применение инфузионной терапии (на начальном этапе коллоидные растворы в дозе 20 мл/кг, а затем 0,50 физиологический раствор с добавлением калия или раствор Рингер-лактата);
- антибиотикотерапию.
При наличии синдрома Беквита – Видеманна необходим контроль за уровнем глюкозы.
Поскольку у детей с эмбриональной грыжей при радикальной операции повышается внутрибрюшное давление, а повышенное натяжение брюшной стенки и высокое стояние диафрагмы вызывает дыхательные расстройства, необходимо в процессе операции измерять интрагастральное давление или давление в системе верхней и нижней полых вен (либо и то и другое).
В раннем послеоперационном периоде проводится:
- искусственная вентиляция легких;
- обезболивание;
- антибактериальная терапия.






























